项目承担单位信息
项目申请人基本信息
| 姓名 | 林偲进 | 性别 | 男 |
|---|---|---|---|
| 国籍 | 中华人民共和国 | 出生日期 | 1994-07-28 |
| 专业技术职务 | 医师 | 所从事专业或方向 | 乳腺肿瘤的基础与转化研究 |
| 工作单位及部门 | 复旦大学附属肿瘤医院 | 社会保险缴纳单位 | 无 |
| 进入现单位时间 | 2023-08-01 | 与现单位工作合同起止年月 | 2023-08至2026-07 |
| 电话 | 18217731297 | 传真 | 64175590 |
| 手机号码 | 18217731297 | 电子邮箱 | cjlin20@fudan.edu.cn |
| 通讯地址 | 上海市徐汇区东安路270号 | 邮编 | 200032 |
| 博导资格批准文件 | 职称证书 |
项目基本信息
| 项目名称 | KRAS扩增通过促进CCR7+树突状细胞浸润增敏TP53突变型三阴性乳腺癌免疫治疗的机制研究 | ||
|---|---|---|---|
| 项目开始日期 | 2024-10-01 | 项目结束日期 | 2027-09-30 |
| 联系人 | 林偲进 | 电话 | 18217731297 |
| 传真 | 64175590 | ||
| 科研部门电子邮箱 | 18017313095@163.com | 财务部门电子邮箱 | 494851342@qq.com |
| 单位需要说明的问题 | 无 | ||
| 中文摘要 | 三阴性乳腺癌(TNBC)的基因组导向精准治疗面临受益人群有限和易耐药性的挑战,原因之一在于过度关注单一驱动性基因组变异,而忽略基因变异互作对疗效的影响。申请人基于多组学数据发现TP53突变型TNBC中存在高频KRAS拷贝数扩增(TP53mut-KRASamp),并与免疫微环境激活有关。临床前模型证实TP53mut-KRASamp与免疫治疗效果相关,且经免疫治疗后TP53mut-KRASamp肿瘤微环境内CCR7+树突状细胞水平升高,但具体招募机制待进一步探索。初步体外实验表明,TP53mut-KRASamp促进CCL21等多种细胞因子分泌。因此,我们推测TP53mut-KRASam可调控CCL21等细胞因子的表达,促进CCR7+树突状细胞浸润、增敏TNBC的免疫治疗。最终,我们利用临床队列验证TP53mut-KRASamp预测TNBC免疫治疗疗效的潜力,并期望基于此扩大免疫治疗的获益人群。 | ||
项目领域
| 科学领域 | 医学科学/肿瘤学/肿瘤综合治疗,医学科学/肿瘤学/乳腺肿瘤 |
|---|---|
| 技术领域 | 无 |
| 行业领域 | 无 |
| 中文关键词 | 乳腺肿瘤,精准治疗,基因组变异互作,基因组学,免疫治疗 |
| 英文关键词 | Breast neoplasm,Precision treatment,Genetic interaction,Genomics,Immunotherapy 乳腺肿瘤,精确治疗,基因相互作用,基因组学,免疫疗法 |
研究的关键科学问题及意义
1.1 三阴性乳腺癌精准治疗疗效个体差异大、获益人群有限,是临床治疗的难点
根据2024年统计数据,乳腺癌已成为全球发病率最高的恶性肿瘤,同时也是我国女性发病率第二高的恶性肿瘤[1,2]。三阴性乳腺癌(triple-negative breast cancer,TNBC)不表达雌激素受体、孕激素受体和人表皮生长因子受体2,约占全亚型乳腺癌的10-15%,具有异质性高和预后差等特点,其治疗策略相对有限,主要依赖化疗,但效果并不理想[3-5]。申请人在先前的研究中,针对晚期乳腺癌患者开发了再分期系统,以期优化个体化治疗决策(J Natl Compr Canc Netw 2019,申请人为第一作者)[6]。然而,申请人发现TNBC患者无论分期如何,接受化疗后预后均不佳。此外,临床上针对TNBC的各类靶向治疗仍处于初探阶段,尚无可广泛应用的治疗靶点[7]。因此,TNBC仍是目前乳腺癌治疗领域的难点。
随着二代测序技术的推广及对肿瘤基因组认知的深入,肿瘤精准治疗已取得显著进展,并对TNBC的治疗模式产生了积极的影响[10]。目前,针对TNBC的新兴治疗方式,如PARP抑制剂和免疫检查点抑制剂等,已在临床实践中显示出其治疗潜力[11-14]。然而,尽管部分靶向治疗策略在TNBC中已初见成效,但疗效预测指标仍局限于BRCA1、BRCA2和PALB2基因的胚系致病性变异[15]。并非所有携带这些基因变异的患者均有临床获益,疗效个体差异大且部分患者易耐药[11,12]。究其原因,可能为目前TNBC的临床实践中,精准治疗决策通常过度关注单一驱动性基因组变异,而忽视了多基因变异互作对疗效的影响。 因此,TNBC的精准治疗决策需综合考虑基因组变异互作对治疗疗效的影响。
此外,针对TNBC精准治疗面临的获益人群有限等问题,目前也亟需寻找新的标志物来筛选潜在获益人群。比如,目前已报道的免疫治疗疗效预测指标仅包括PD-(L)1表达、肿瘤突变负荷和微卫星不稳定等[16],仅覆盖小部分患者。这提示除了关注单一驱动性基因组变异事件以外,鉴定其他临床级疗效预测指标的必要性。因此,推动TNBC的精准治疗需要深入解析TNBC基因组变异互作,以发现新的治疗靶点和疗效预测标志物,从而扩大TNBC精准治疗的获益人群。
1.2 基因组变异互作影响肿瘤精准治疗疗效
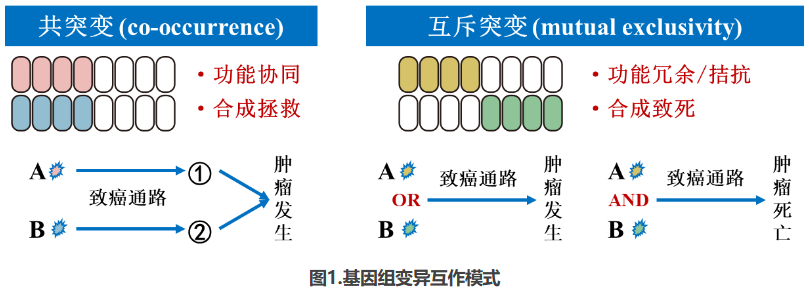
肿瘤的发生和发展是一个复杂的多步骤过程,这一过程由连续发生的基因组变异事件驱动,且基因组变异事件的发生呈现“非随机”和“受调控”的特征[17]。基因组变异的共现(co-occurrence)和互斥(mutual exclusivity)现象揭示了基因变异之间可能存在的功能互作关系(图1)。共现的基因变异可能表明它们在功能上具有协同作用[18],或者在某些情况下,它们可能通过合成拯救机制来抵抗单一基因变异的靶向治疗,从而与耐药性相关[19]。如携带BRCA1/2致病性胚系变异的患者,若同时携带MRE11拷贝数扩增或TP53BP1失活性突变,则易出现PARP抑制剂耐药[20]。此外,共突变现象也被多项研究证明可以预测乳腺癌新辅助及晚期治疗的疗效[21,22]。相反,互斥的基因变异则可能表明它们在功能上存在冗余或拮抗作用[23],或者它们之间可能存在合成致死的关系[23]。这些发现对于理解肿瘤的分子机制和开发新的治疗策略具有重要意义。
在该领域,申请人在前期研究中深入探索了基因组变异互作与精准治疗疗效的相关性,发现TP53突变-AURKA扩增互作介导他莫昔芬耐药(Cancer Cell 2024,申请人为第一作者)[24],DNA损伤修复通路内胚系-体细胞变异互作影响铂类和PARP抑制剂疗效(Cell Discovery 2023,申请人为共同第一作者排名第二)[25],及细胞周期通路内的基因组变异互作提示CDK4/6抑制剂联合PARP抑制剂的协同治疗敏感性(Nature Genetics 2023,申请人为共同第一作者排名第五)[26]。这些发现不仅为理解肿瘤基因组变异互作的生物学机制提供了新的视角,也为未来的精准治疗策略的开发提供了重要的科学依据。尽管肿瘤基因组变异互作受到越来越多的关注,但其影响肿瘤精准治疗疗效背后的生物学机制仍亟待探索。
1.3 基因组变异互作调控肿瘤免疫微环境
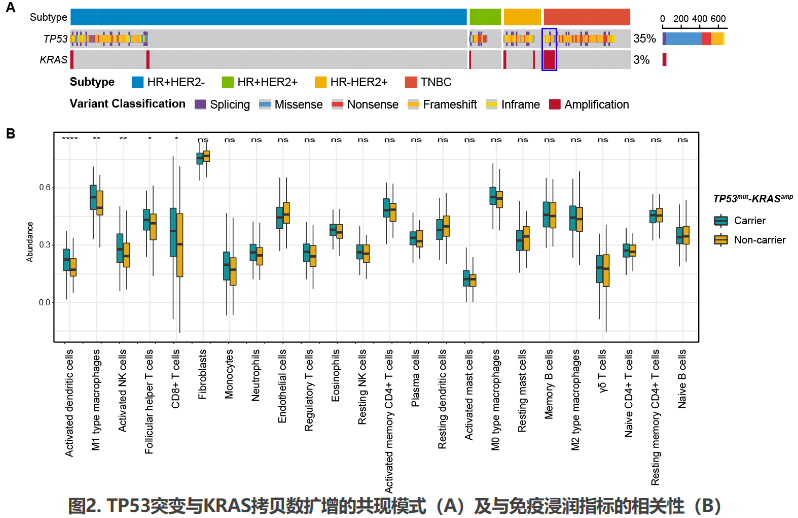
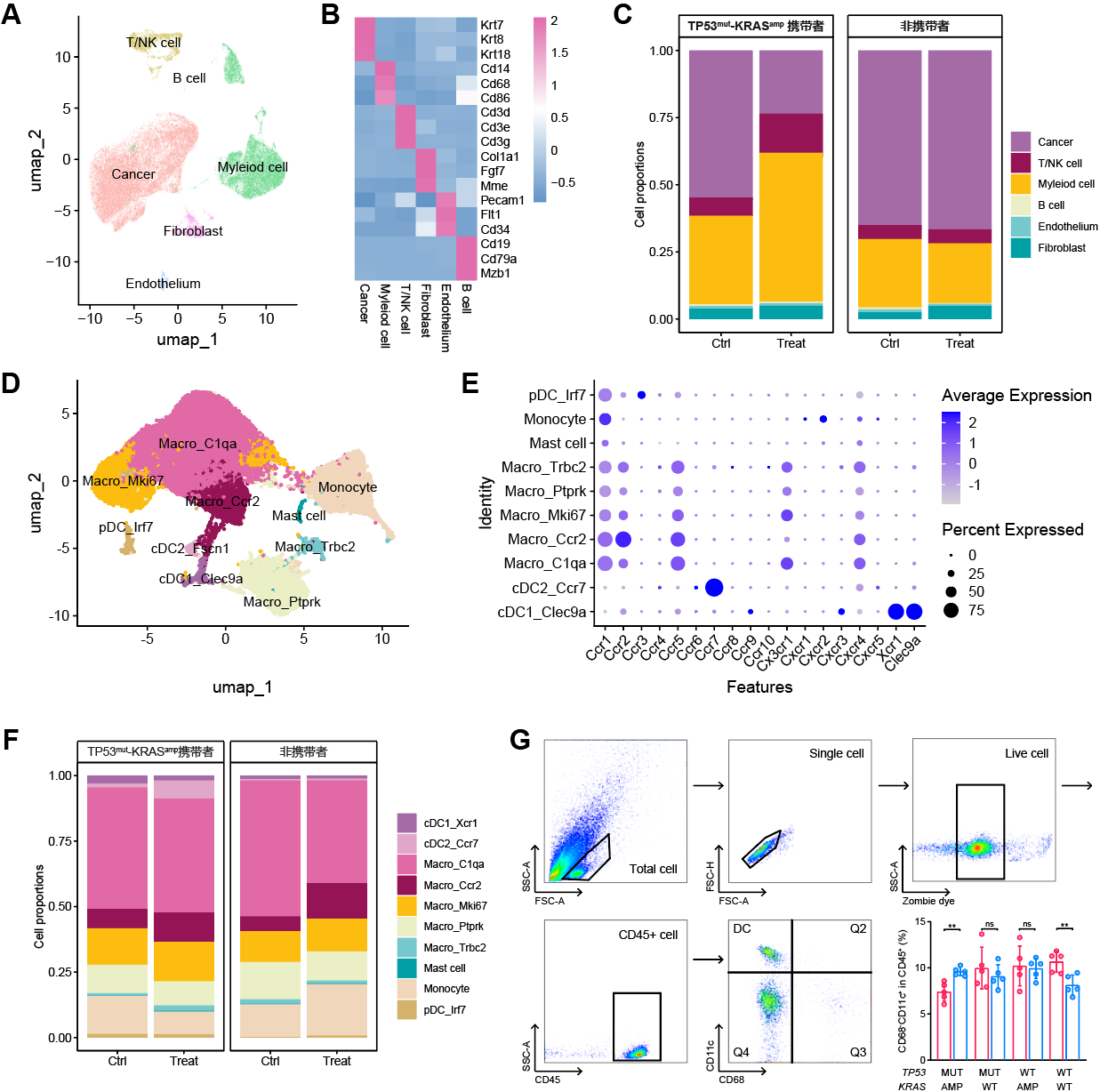
既往研究发现部分基因变异互作事件影响肿瘤免疫微环境。KRASG12D突变的肿瘤在LKB1共突变的情况下,会驱动形成免疫抑制型肿瘤微环境。这种环境表现为效应T细胞浸润水平下降、耗竭水平升高,免疫抑制性中性粒细胞浸润水平升高,以及PD-L1表达水平下降[27,28]。此外,KRAS-MYC共突变通过多种途径诱导免疫逃逸,包括T/B/NK细胞浸润下降、巨噬细胞招募及免疫抑制性血管内皮生长因子分泌[29]。申请人前期基于英国METABRIC队列的调研显示,TNBC中存在显著的TP53突变与KRAS拷贝数扩增的共现(TP53mut-KRASamp)(图2A),且该基因组变异互作事件与免疫浸润水平升高相关,特别是与树突状细胞浸润相关(图2B)。树突状细胞是一组高异质性的抗原呈递细胞,可通过多种机制增强抗肿瘤免疫[30]。其中,经典树突状细胞I型(conventional dendritic cell type I,cDC1)高表达HLA-DR、CLEC9A、CD141及XCR1等,在抗肿瘤免疫中发挥重要功能[31]。cDC1可通过呈递肿瘤新抗原、表达共刺激分子和分泌可溶性细胞因子激活CD8+T细胞,增强其杀伤能力[32]。此外,cDC1趋化至肿瘤微环境后,亦可局部调控多种免疫细胞的功能[31]。既往有研究通过解析TNBC微环境内树突状细胞的异质性,发现特定亚群的树突状细胞水平与免疫治疗疗效相关[33]。因此,我们推测TP53mut-KRASamp或可通过调控树突状细胞的招募影响TNBC肿瘤免疫微环境,进而可能影响免疫治疗疗效。
既往研究报道TP53突变抑制T细胞及NK细胞招募所需的细胞因子分泌[34],而TP53与KRASG12D共突变时则促进干扰素γ分泌及免疫微环境激活,且提示更好的免疫治疗疗效[35]。目前,TP53突变与KRAS拷贝数扩增的共现未见报道,且其对TNBC肿瘤微环境和免疫治疗疗效的影响也尚不明确。我们推测TP53mut-KRASamp通过调控相关细胞因子分泌影响TNBC微环境树突状细胞的招募。因此,深入解析TP53mut-KRASamp互作调控TNBC微环境的具体机制,有望进一步鉴定新的免疫治疗疗效预测标志物,扩大TNBC免疫治疗的获益人群。这不仅有助于提高TNBC患者的治疗效果,也为未来的临床研究和治疗策略提供了新的方向。
1.4 前期研究结果初步发现TP53mut-KRASamp可能影响TNBC微环境免疫细胞浸润
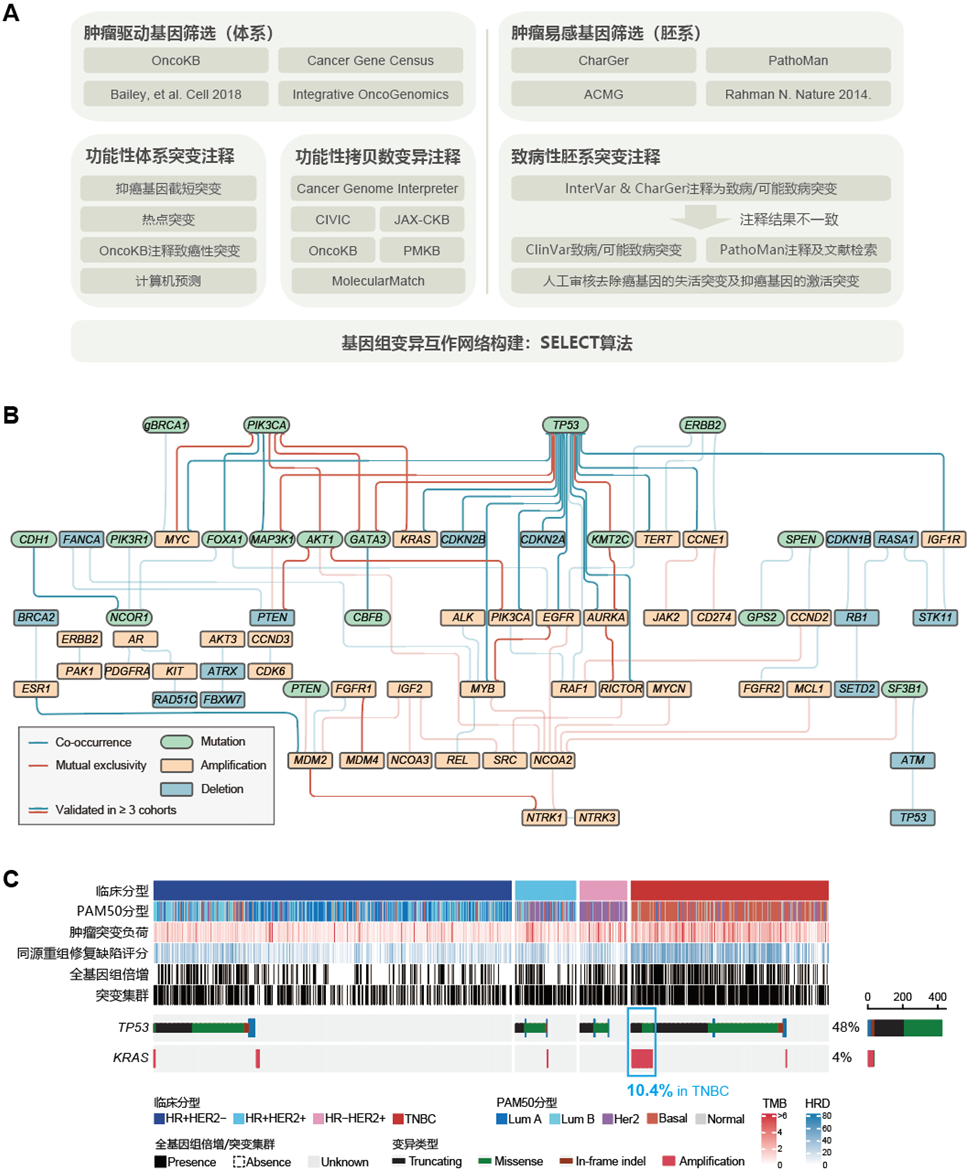
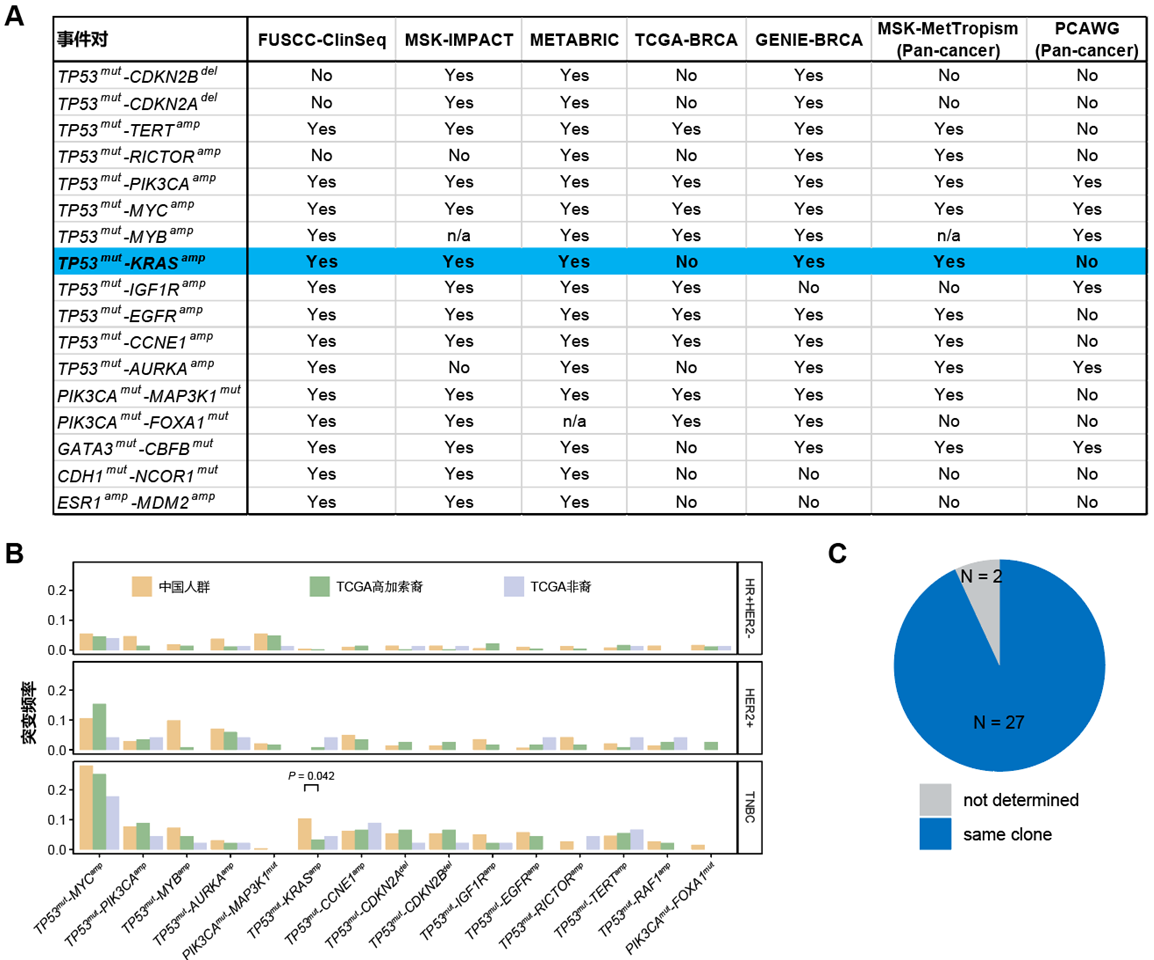
前期申请人所在团队已完成了乳腺癌靶向测序队列构建及多维度分子图谱描绘,相关成果发表于Cell Discovery(申请人为共同第一作者排名第二)及Nature Cancer[25,36]。该研究为本课题提供了重要的研究基础。申请人发现TNBC中存在显著的TP53突变和KRAS拷贝数扩增的共现。携带TP53mut-KRASamp的TNBC患者占所有TNBC的10.4%,占比较高(图3),这一发现在多个外部队列中得到了验证(图4) ,表明TP53突变和KRAS拷贝数扩增的共现不仅在TNBC中普遍存在,而且可能对TNBC的生物学特征和治疗响应产生重要影响。我们随后开展了一系列前期研究探索TP53mut-KRASamp对TNBC生物学特征的影响。
图3. TNBC基因组变异互作网络构建
(A)驱动基因及功能性变异筛选;(B)TNBC基因组变异互作网络;(C)TP53突变与KRAS拷贝数扩增在TNBC中显著共现。
图4.基因组变异互作事件的外部验证
(A)外部验证提示TP53mut-KRASamp在5个队列中得到验证;(B)中国人群TNBC中TP53mut-KRASamp发生频率显著高于TCGA高加索人群TNBC;(C)共突变克隆性分析提示TP53突变与KRAS拷贝数扩增发生于同一克隆中。
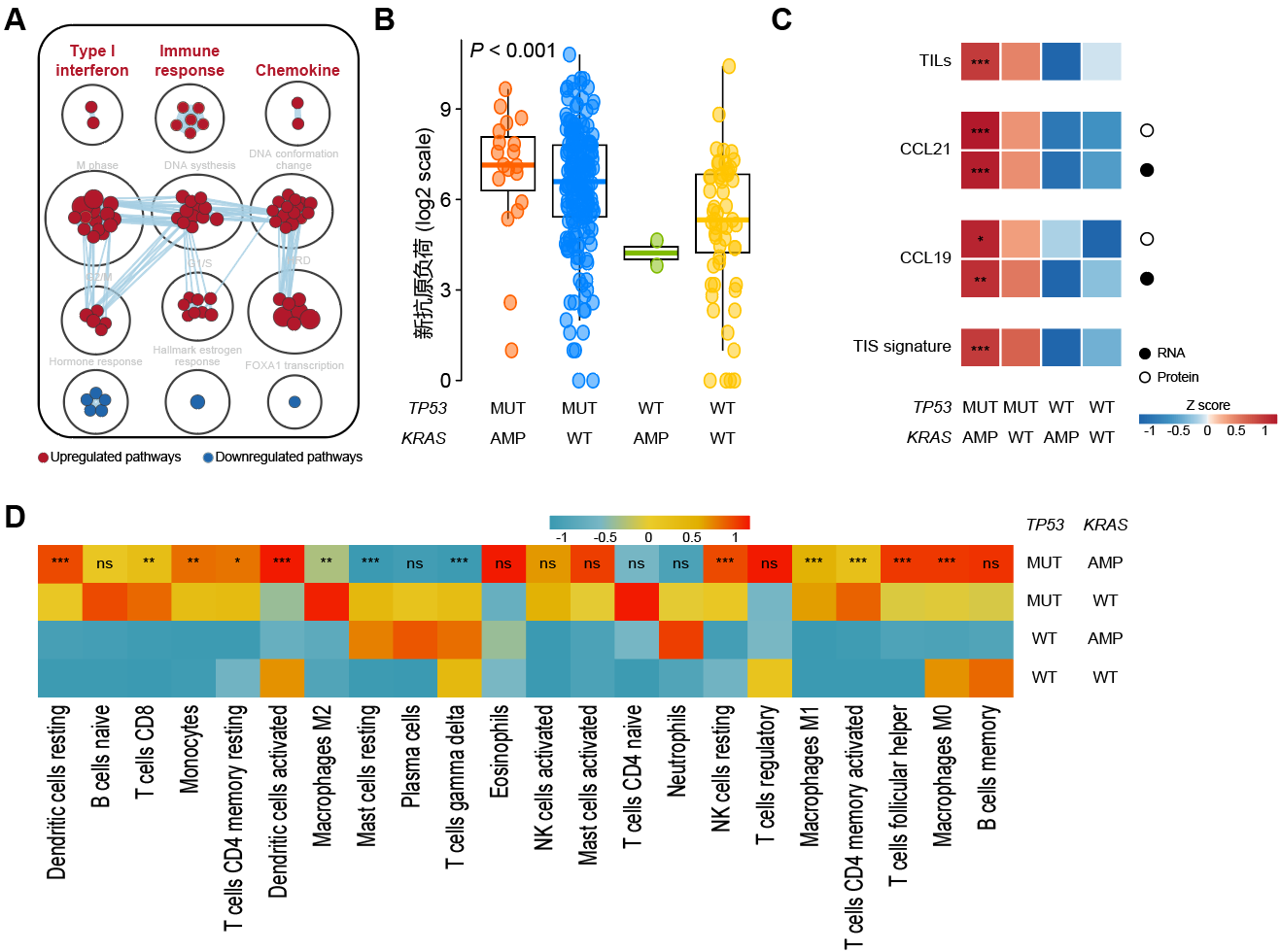
1)多组学分析:相较于单突变组(仅TP53突变或KRAS扩增),携带TP53mut-KRASamp的TNBC中,下游通路改变以多条抗原呈递通路上调为主,免疫细胞浸润水平(如树突状细胞等)及趋化因子表达水平升高(图5);
图5. TP53mut-KRASamp与免疫微环境表型的相关性
(A)GSEA分析提示免疫相关通路激活;(B)Polysolver分析提示TP53mut-KRASamp肿瘤新抗原负荷升高;(C)TP53mut-KRASamp与其他免疫相关特征的相关性;(D)ssGSEA推测肿瘤微环境内各免疫细胞丰度。
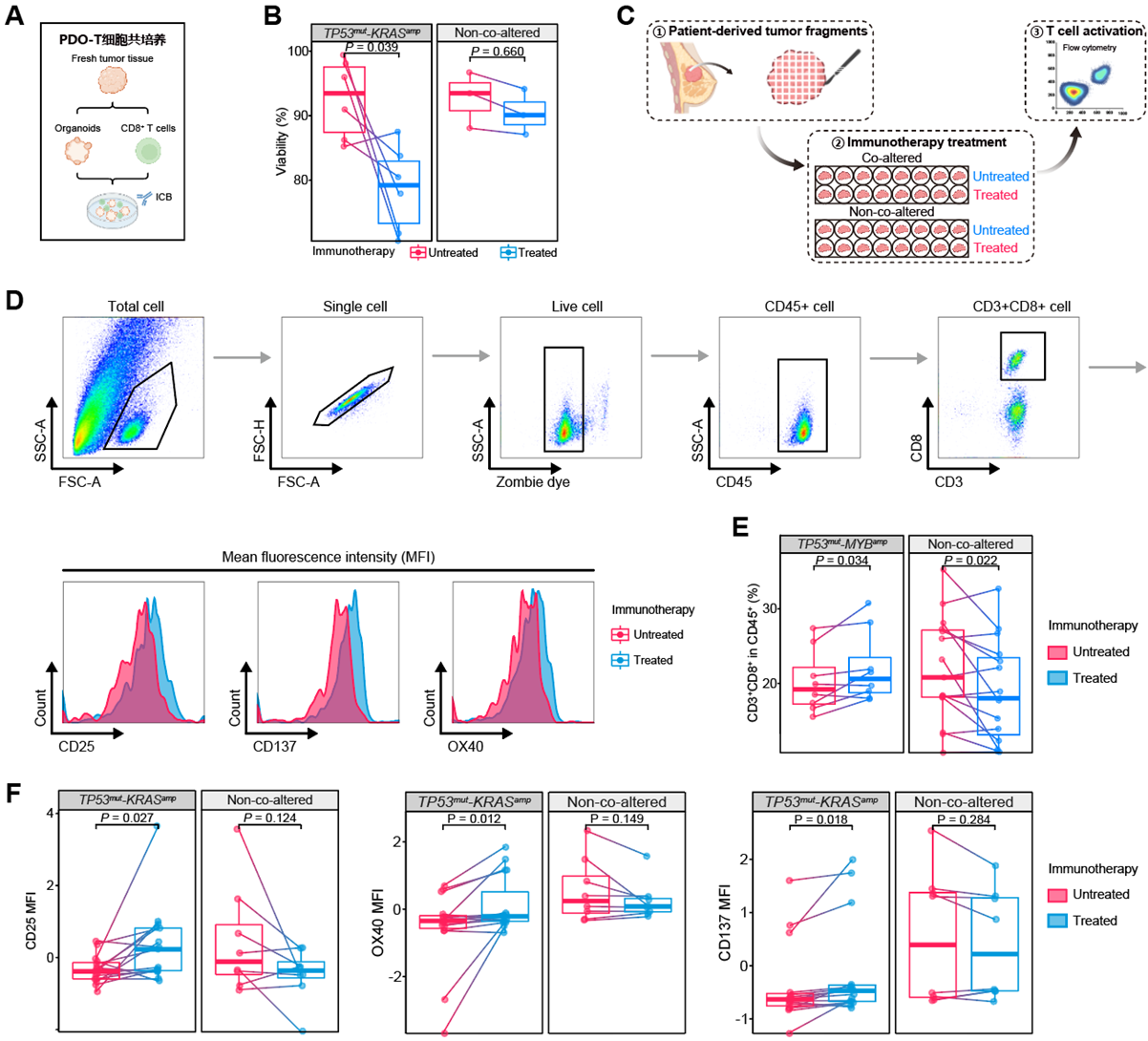
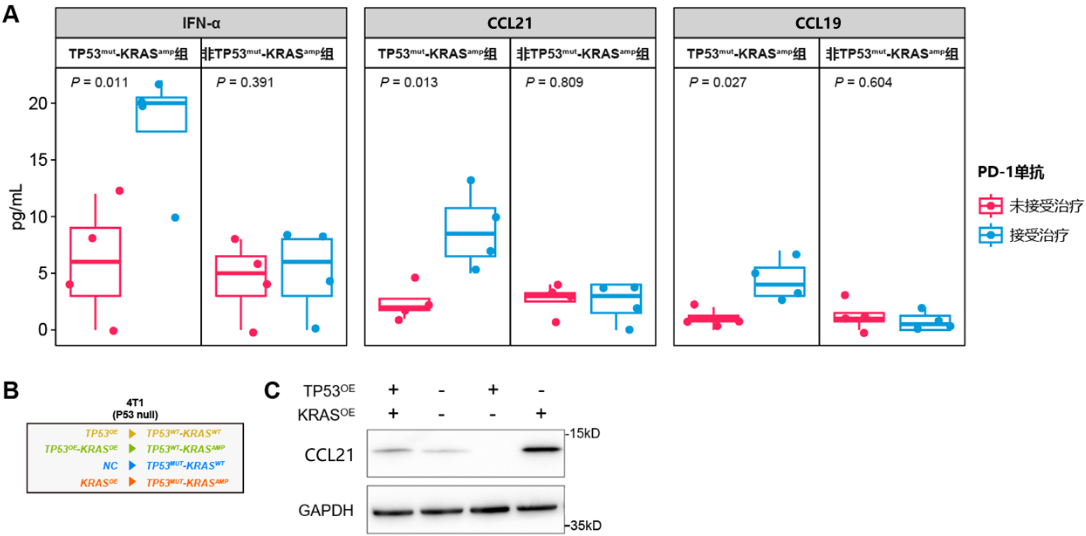
2)初步表型实验:经PD-1单抗处理后,携带TP53mut-KRASamp的患者来源类器官(patient-derived organoid,PDO)和CD8+肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)共培养体系中PDO的活性下降,且患者来源的肿瘤组织碎片(patient-derived tumor fragment,PDTF)内CD3+CD8+ T细胞水平升高,CD25、OX40及CD137等免疫激活指标和IFN-α、CCL21及CCL19等免疫激活性趋化因子水平亦升高(图6);且经过PD-1单抗处理后,TP53mut-KRASamp的PDTF上清中IFN-α、CCL21和CCL19水平显著升高,蛋白水平进一步验证TP53mut-KRASamp状态影响CCL21蛋白表达水平(图7);
图6.体外模型验证TP53mut-KRASamp与TNBC免疫治疗疗效的相关性
(A)PDO-T细胞共培养模式图;(B)PD-1单抗处理后不同共突变状态的PDO的活性变化;(C)PDTF实验流程模式图;(D)PDTF流式细胞术圈门策略;(E)PD-1单抗处理后不同共突变状态的PDTF内CD3+CD8+T细胞浸润水平变化;(F)PD-1单抗处理后不同共突变状态的PDTF内T细胞激活相关指标水平变化。
图7. TP53mut-KRASamp肿瘤接受PD-1单抗治疗后CCL21水平升高
(A)TP53mut-KRASamp肿瘤接受PD-1单抗治疗后多种细胞因子水平升高;(B)构建不同共突变状态稳转株的模式图;(C)TP53mut-KRASamp状态影响CCL21蛋白表达水平。
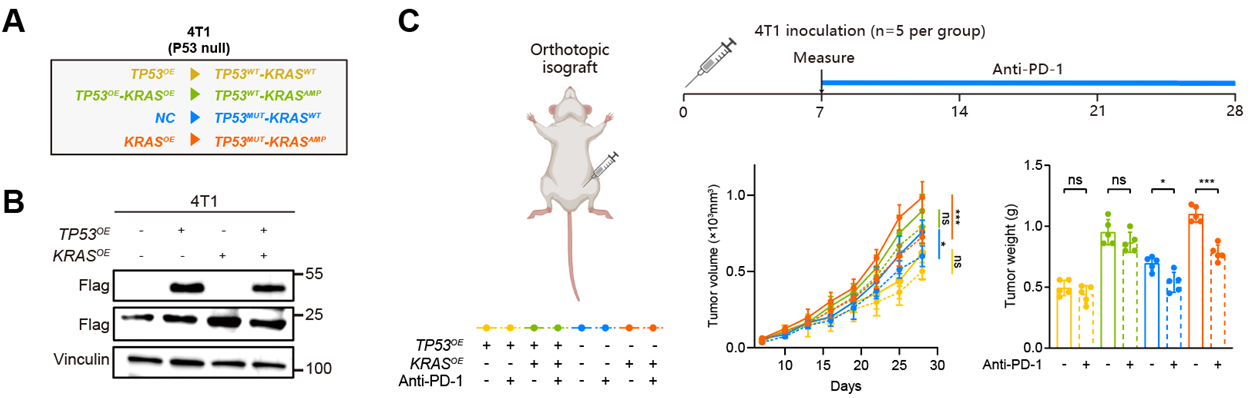
3)初步体内实验:携带TP53mut-KRASamp的4T1小鼠模型经PD-1单抗处理后肿瘤生长受限(图8);单细胞测序发现PD-1单抗处理后TP53mut-KRASamp的小鼠肿瘤中CCR7+树突状细胞水平升高,且流式细胞术进一步验证树突状细胞的水平升高(图9)。因此,我们推测TP53mut-KRASamp通过促进CCR7+树突状细胞的招募增敏TNBC免疫治疗;
图8. 体内模型验证TP53mut-KRASamp与TNBC免疫治疗疗效的相关性
(A)基于4T1细胞系构建不同共突变状态稳转株的模式图;(B)基于4T1构建不同共突变状态稳转株;(C)体内模型验证TP53mut-KRASamp与TNBC PD-1单抗疗效的相关性。
图9.TP53mut-KRASamp肿瘤微环境内CCR7+树突状细胞浸润水平增加
(A-B)小鼠4T1原位成瘤模型单细胞分群;(C)小鼠4T1原位成瘤模型接受PD-1单抗处理后微环境组成变化;(D)髓系细胞分群;(E)各髓系细胞分群趋化因子受体表达情况;(F)小鼠4T1原位成瘤模型接受PD-1单抗处理后髓系细胞分群变化;(G)流式细胞分析验证DC细胞水平变化。
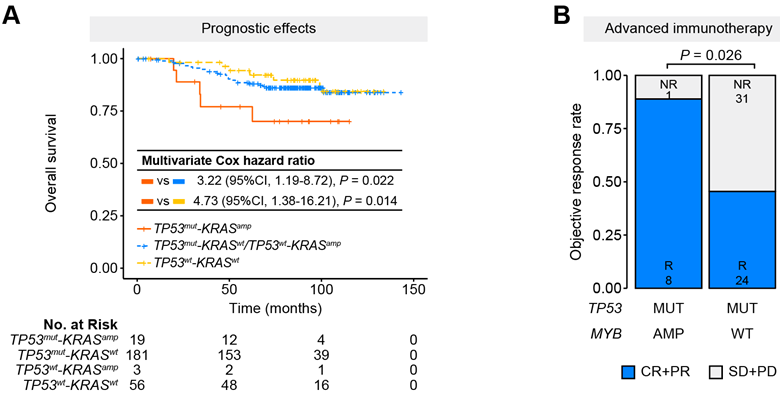
4)临床验证:生存分析提示TP53mut-KRASamp与TNBC患者的不良预后相关,且是独立的预后预测因子(图10);在本中心的TNBC晚期免疫治疗队列中,携带TP53mut-KRASamp的患者疗效更佳,提示TP53mut-KRASamp或可作为TNBC免疫治疗的疗效预测指标(图10)。
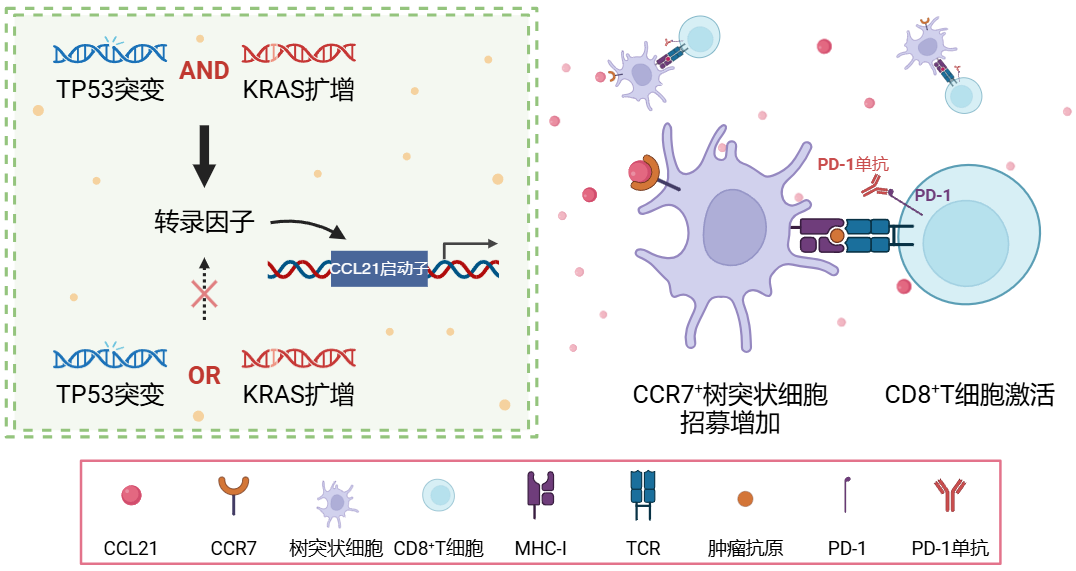
基于以上前期研究结果,我们推测肿瘤基因组变异互作TP53mut-KRASamp可促进TNBC免疫微环境激活,且与TNBC免疫治疗较好的疗效相关。然而,其背后的具体分子机制仍待进一步探索。
1.5 本项目的立项假说及研究意义
立足于前期研究基础,我们提出了新的假说(图11):肿瘤基因组变异互作事件TP53mut-KRASamp通过调控CCL21等细胞因子表达,进而诱导CCR7+树突状细胞的浸润、增敏TNBC免疫治疗。为了验证该假说,我们将从细胞、类器官、动物模型、临床组织样本及临床队列等不同层次,系统性地研究基因组变异互作TP53mut-KRASamp调控肿瘤免疫的具体机制。本项目有望鉴定新的TNBC免疫治疗疗效预测标志物,从而扩大TNBC免疫治疗的获益人群。
参考文献(申请人以第一/共同第一作者发表的论文以粗体及下划线标出)
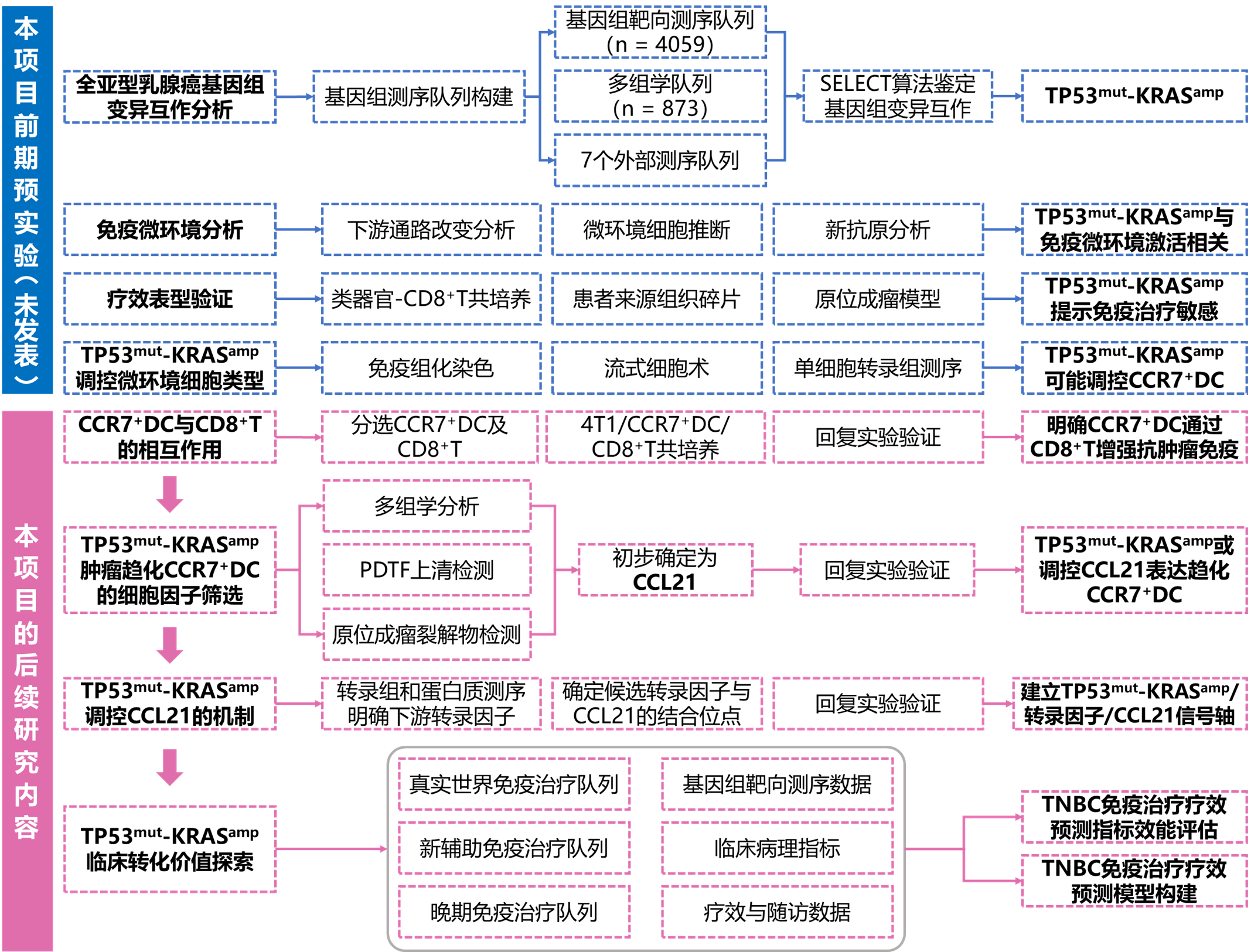
研究内容、技术关键和实施方案
2.1 研究目标
本课题立足于申请人的前期研究基础,拟进一步阐明基因组变异互作事件TP53mut-KRASamp调控TNBC免疫微环境的分子机制。本研究有望揭示基因组事件调控TNBC免疫微环境的新机制,鉴定新的TNBC免疫治疗疗效预测标志物,从而扩大TNBC免疫治疗的获益人群、优化基因组学指导下的TNBC精准治疗策略。
具体研究目标包括:
(1)明确表型:确定TP53mut-KRASamp对TNBC微环境表型的影响;
(2)解析机制:阐明TP53mut-KRASamp通过调控细胞因子CCL21的表达,进而影响CCR7+树突状细胞浸润的具体机制;
(3)关联临床:探索TP53mut-KRASamp对TNBC免疫治疗敏感性的预测价值,为临床筛选TNBC免疫治疗敏感人群提供新的标志物。
2.2 研究内容
申请人将通过多组学分析、多维度表型验证及深入的机制探索阐释在TNBC中,TP53突变与拷贝数扩增相较于单基因变异(仅TP53突变或仅KRAS拷贝数扩增)存在显著的生物学功能协同并影响患者治疗结局。
主要研究内容如下:
第一部分:使用多组学队列筛选TNBC中的基因组变异互作事件,并鉴定其中与免疫微环境表型相关的事件
申请人利用前期构建的乳腺癌多组学数据库和靶向测序数据库,通过对基因组学数据的生物信息学分析,鉴定TNBC中显著的基因组变异互作事件。结合表达谱、微环境分型、新抗原和代谢物丰度等数据,鉴定出TNBC中与免疫微环境激活相关的基因组变异互作事件TP53mut-KRASamp,拟进一步在TCGA、METABRIC和PCAWG等多个外部队列中验证上述发现。
第二部分:利用临床前模型验证TP53mut-KRASamp对TNBC免疫治疗疗效的影响
(1)体外实验:申请人所在团队前期已搭建PDO及PDTF平台,且各PDO及PDTF均有对应的基因组靶向测序数据。因此,申请人将筛选不同基因型的PDO,进行PDO和CD8+T细胞的共培养,给予抗PD-1单抗处理后检测肿瘤活性。此外,申请人使用抗PD-1单抗处理不同基因型的PDTF,通过流式细胞术分析给药前后CD3+CD8+ T细胞丰度及CD25、OX40及CD137等免疫激活相关指标的改变。
(2)体内实验:基于前期研究发现在TNBC中,与KRAS拷贝数扩增共现的TP53突变主要为功能失活性突变,因此申请人利用TP53缺失(TP53 null)且相对低表达KRAS的小鼠TNBC细胞系4T1构建具有不同基因特征的细胞模型(TP53wt-KRASwt、TP53mut-KRASwt、TP53wt-KRASamp及TP53mut-KRASamp)。
申请人将不同基因型的4T1细胞分别种植于免疫功能正常的BALB/c小鼠乳腺脂肪垫,构建小鼠原位成瘤模型。随后,对每只小鼠分别进行抗PD-1单抗和IgG给药。3周左右取瘤体,通过分析体内肿瘤生长曲线及瘤体重量,验证基因组变异互作事件TP53mut-KRASamp对TNBC免疫治疗疗效的影响。
第三部分:体内外实验解析TP53mut-KRASamp调控的肿瘤微环境表型及具体机制
(1)TP53mut-KRASamp影响的关键免疫微环境细胞类型:基于上述基小鼠4T1细胞系的体内实验,3周左右取小鼠原位成瘤瘤体进行流式细胞术检测、免疫组化染色和单细胞转录组测序,精细解读不同基因型肿瘤微环境中关键细胞类型的具体变化,鉴定TP53mut-KRASamp影响的关键免疫微环境细胞类型(如树突状细胞;单细胞分析发现TP53mut-KRASamp肿瘤经PD-1单抗处理后微环境中CCR7+树突状细胞上调),并阐释关键微环境细胞类型的具体表型变化;在确定具体细胞类型后,我们将通过CCR7+树突状细胞与CD8+T细胞的体外共培养进一步确认CCR7+树突状细胞对CD8+T细胞的杀伤功能影响。
(2)TP53mut-KRASamp影响关键微环境细胞类型的具体机制:前期研究发现携带TP53mut-KRASamp的TNBC中趋化因子通路、干扰素通路及免疫应答通路上调;此外,蛋白组分析提示TP53mut-KRASamp的TNBC高表达免疫激活性趋化因子(如CCL21、CCL19、CCL4、CCL5、CCL20等),其中CCL21蛋白差异最为显著;提示TP53mut-KRASamp或可调控细胞因子CCL21的表达促进特定免疫细胞亚群趋化。因此,申请人利用两株人源性TNBC细胞系MDA-MB-231和 BT-549构建不同基因型的稳转株。通过RNA-seq测序和基因富集分析,验证影响的关键信号通路变化;通过qPCR及Western blot等实验技术,在细胞系、小鼠瘤体中进一步验证包括CCL21在内的细胞因子在mRNA和蛋白水平的表达量变化。
为进一步鉴定TP53mut-KRASamp调控细胞因子表达的具体机制,申请人通过转录组和蛋白组的差异分析筛选TP53mut-KRASamp调控的转录因子,并确定候选转录因子与CCL21的结合位点,最后通过Luciferase和CHIP-qPCR实验验证。最后,我们将使用细胞因子CCL21的中和抗体抑制CCR7+树突状细胞的趋化以进一步明确TP53mut-KRASamp/转录因子/CCL21/CCR7+树突状细胞信号轴。
第四部分:使用临床样本探索TP53mut-KRASamp/转录因子/CCL21/CCR7+树突状细胞轴在TNBC中的临床转化价值
(1)验证TP53mut-KRASamp作为疗效预测标志物的效能:本中心临床治疗队列丰富,包括TNBC新辅助免疫治疗队列及晚期免疫治疗队列等,且各患者均有完善的疗效信息记录及匹配基因组靶向测序数据。我们通过鉴定TNBC免疫治疗队列中TP53及KRAS的状态,分析TP53mut-KRASamp与免疫治疗疗效的相关性。
(2)构建TNBC免疫治疗疗效预测模型:我们将结合患者临床治疗信息、关键病理及免疫组化指标、TP53mut-KRASamp状态及其他基因组数据,构建TNBC患者免疫治疗疗效预测模型
2.3 技术关键
(1)基因组变异互作事件鉴定技术:
1)使用SELECT算法在乳腺癌多组学队列中鉴定TNBC中的显著基因组变异共/互斥事件。
2)构建随机数据集以确保统计分析的稳健性。
3)利用EstmateClonality、Absolute和Battenberg算法计算共现基因组变异事件的克隆性。
(2)基因组变异与免疫微环境表型相关性分析技术:
1)利用TNBC转录组和蛋白组数据,分析基因组变异互作与免疫分子表达的关系。
2)应用ssGSEA算法推算肿瘤微环境中免疫细胞丰度。
3)使用Polysolver算法计算TNBC新抗原负荷。
4)分析基因组变异互作事件与TNBC微环境表型的相关性。
(3)TP53mut-KRASamp对免疫治疗疗效影响的验证技术:
1)体外实验:
a)PDO与CD8+ TILs共培养模型,评估抗PD-1单抗对肿瘤活力和细胞凋亡的影响。
b)PDTF模型,分析免疫激活相关指标的改变。
2)体内实验:
a)构建具有不同基因特征的4T1细胞模型。
b)利用小鼠原位成瘤模型,通过抗PD-1单抗给药验证疗效。
(4)肿瘤微环境表型及调控机制解析技术:
1)免疫组化染色和流式细胞术分析关键免疫微环境细胞类型。
2)单细胞转录组测序以解读关键细胞类型的具体变化。
3)通过转录组测序和蛋白组分析筛选关键信号通路和细胞因子。
4)利用荧光素酶报告系统明确转录因子与CCL21的结合位点。
2.4 拟解决的关键科学问题
(1)基因组变异互作事件TP53mut-KRASamp通过何种机制重塑TNBC免疫微环境,并增敏免疫治疗?
根据前期数据,我们发现肿瘤基因组变异互作TP53mut-KRASamp可提示TNBC免疫微环境激活,且与TNBC免疫治疗较好的疗效相关。然而, TP53mut-KRASamp重塑免疫微环境的具体机制仍待进一步研究。我们推测可能的机制为通过调控细胞因子CCL21的转录因子影响CCL21表达,进而趋化特定免疫细胞亚群。因此,我们将通过测序分析、细胞因子定量和体外共培养等方法,详细阐明调控机制。
(2)基因组变异互作事件TP53mut-KRASamp如何指导TNBC的精准治疗?
目前已报道的免疫治疗疗效预测标志物仅包括PD-(L)1表达水平、肿瘤突变负荷和微卫星不稳定性等,仅覆盖小部分患者。这也提示我们除了关注于单一基因组变异事件以外,鉴定其他临床级疗效预测标志物的必要性。因此,本研究拟探讨TP53mut-KRASamp及其调控的关键微环境细胞类型是否可以指导TNBC的临床决策。我们将利用本中心实验平台丰富的细胞系、类器官、患者来源的肿瘤组织碎片及动物模型研究TP53mut-KRASamp与TNBC免疫治疗敏感性的相关性。此外,我们将充分利用本中心的临床队列资源和TNBC免疫治疗临床试验验证TP53mut-KRASamp是否可作为TNBC免疫治疗的临床级疗效预测标志物,并结合多种临床病理指标和基因组特征构建TNBC免疫治疗疗效预测模型。
2.5 研究方法(技术路线图见图4)
(1)筛选TNBC中的基因组变异互作事件,并鉴定其中与免疫微环境表型相关的事件
1)基因组变异互作事件鉴定:基于本中心构建的乳腺癌多组学队列及基因组靶向测序队列,申请人利用SELECT算法鉴定TNBC中显著的基因组变异的共/互斥事件。由于单个基因组变异突变频率的高低会影响共互斥事件的鉴定概率,因此我们基于原始基因组测序数据集构建了随机数据集,并在随机数据集上迭代执行了 SELECT 算法。该随机数据集中,每个样本和肿瘤亚型中每个基因组变异的发生频率与原始基因组测序数据集保持一致,确保我们可以对基因组变异共互斥事件进行稳健的统计分析。我们保留FDR < 0.05且SELECT score大于特定阈值的基因组变异互作事件。随后,我们在TCGA、MSK-IMPACT、PCAWG、METABRIC、MSK-MetTropism、PCAWG及AACR-GENIE等7个外部队列中验证各基因组变异互作事件的稳健性。最后,我们利用EstmateClonality、Absolute和Battenberg算法计算共现的基因组变异事件是否发生于肿瘤的同一克隆内。
2)基因组变异互作事件与免疫微环境表型的相关性分析:申请人利用本中心的TNBC转录组及蛋白组数据,分析基因组变异互作与免疫相关分子表达的关系。此外,我们利用ssGSEA算法在本中心TNBC转录组数据中推算肿瘤微环境中各个免疫细胞的丰度;利用Polysolver算法计算TNBC新抗原负荷。随后,我们利用上述指标分析基因组变异互作事件与TNBC微环境表型的相关性。
(2)验证TP53mut-KRASamp对TNBC免疫治疗疗效的影响
1)体外实验:由于常规的体外细胞系事件较难验证免疫治疗疗效相关性,我们采用了本中心前期搭建的其他两种体外模型平台进行后续实验,且下述体外模型均匹配本中心精准检测平台的基因组靶向测序数据。
a)PDO与CD8+ TILs共培养模型:通过匹配的基因组靶向测序数据确定PDO的基因型。来自相同组织的CD8+ TILs通过荧光激活细胞分选纯化。在分析前,以1:5的比例将PDO与TILs共同培养2天。在培养液中加入抗-PD-1单抗(10μg/ml)或抗-CD3(5μg/ml)和抗-CD28(2μg/ml)单抗。我们分别通过细胞活力检测法、活细胞成像技术和流式细胞数来评估肿瘤活力和细胞凋亡。收集培养上清,通过ELISA试验测定TNF-α和IFN-γ的浓度。
b)PDTF模型:通过匹配的基因组靶向测序数据确定PDTF的基因型。我们将肿瘤内不同区域的PDTF(1-2mm3的肿瘤碎片)混合,以确保能均匀代表整个肿瘤。我们将单个PDTF包埋在人工细胞外基质中。在96孔板上每孔加入40μL基质作为底层,凝固后每孔放入一个PDTF,然后再加入第二层40 μL基质。待基质凝固后,每孔加入20μg/mL nivolumab或人源抗β-Gal-hIgG4单抗作为对照。每组分别使用8个PDTF进行实验。48小时后进行流式细胞术分析给药前后CD3+CD8+ T细胞丰度及CD25、OX40及CD137等免疫激活相关指标的改变。
2)体内实验:基于前期研究发现在TNBC中,与KRAS拷贝数扩增共现的TP53突变主要为功能失活性突变,因此申请人利用TP53缺失(TP53 null)且相对低表达KRAS的小鼠TNBC细胞系4T1构建具有不同基因特征的细胞模型。申请人通过慢病毒包装质粒并感染4T1细胞的方法构建细胞模型。其中:野生型4T1模拟TP53mut-KRASwt细胞模型,随后在此基础上过表达TP53模拟TP53wt-KRASwt细胞模型,过表达KRAS模拟TP53mut-KRASamp细胞模型,以及同时过表达TP53及KRAS模拟TP53wt-KRASamp细胞模型。后续将利用上述4种具有不同基因特征的细胞模型开展实验。
申请人将不同基因型的4T1细胞(2×105个)分别种植于免疫功能正常的BALB/c小鼠乳腺脂肪垫,构建小鼠原位成瘤模型。随后,对每只小鼠分别进行100μg的抗PD-1单抗和IgG给药。定期进行瘤体的测量并记录。3周左右取瘤体并拍照记录。我们使用0.5×最长径×垂直径2计算肿瘤体积,并通过分析体内肿瘤生长曲线及瘤体重量,验证基因组变异互作事件TP53mut-KRASamp对TNBC免疫治疗疗效的影响。
(3)解析TP53mut-KRASamp调控的肿瘤微环境表型及具体机制
1)TP53mut-KRASamp影响的关键免疫微环境细胞类型:基于上述基于小鼠4T1细胞系的体内实验,3周左右取小鼠原位成瘤瘤体一分为二。一份使用固定液固定,随后进行石蜡包埋、切片,并对各瘤体白片进行CD4、CD8、CD68、CD86、CD206、CD11b、CD11c等免疫相关指标的免疫组化染色;另一份放置于新鲜的细胞培养液中进行后续的流式实验,以CD45、CD3e、CD8、GZMB、PRF1、PD-1、CD11b、CD11c、F4/80、CD86、CD206等流式抗体,进行T细胞、巨噬细胞和树突状细胞及其功能亚群的分析,从而明确TP53mut-KRASamp影响的关键免疫微环境细胞类型。此外,我们取部分瘤体送检单细胞转录组测序,以精细解读不同基因型肿瘤微环境中关键细胞类型的具体变化,鉴定TP53mut-KRASamp影响的关键免疫微环境细胞类型,并阐释关键微环境细胞类型的具体表型变化(初定为CCR7+树突状细胞)。
在确定具体微环境细胞类型后,我们将通过流式分选技术分选出CCR7+树突状细胞。同时,我们从免疫正常小鼠脾脏中分选出CD8+T细胞,并用CSFE进行染色标记。我们将CCR7+树突状细胞与小鼠肿瘤细胞共培养2小时,随后再与CSFE-CD8+T细胞共培养20小时。最后,我们通过转录组测序及流式细胞术等技术检测CD8+T细胞的功能状态,以进一步明确CCR7+树突状细胞通过抗原呈递激活CD8+T细胞,从而增强抗肿瘤免疫。
2)TP53mut-KRASamp影响关键微环境细胞类型的具体机制:前期研究发现携带TP53mut-KRASamp的TNBC中趋化因子通路、干扰素通路及免疫应答通路上调;此外,蛋白组分析提示TP53mut-KRASamp的TNBC高表达免疫激活性趋化因子,其中CCL21蛋白差异最为显著;提示TP53mut-KRASamp或可调控细胞因子CCL21的表达促进特定免疫细胞亚群趋化。因此,申请人利用慢病毒包装质粒并感染两株人源TNBC细胞系MDA-MB-231和 BT-549构建不同基因型的稳转株。通过RNA-seq测序和基因富集分析,验证影响的关键信号通路;通过qPCR及Western blot等实验技术,在细胞系、小鼠瘤体中进一步验证相关细胞因子(如CCL21)在 mRNA和蛋白水平的表达量变化。
此外,为进一步鉴定TP53mut-KRASamp通过调控哪些转录因子来调控细胞因子CCL21的转录,申请人通过转录组和蛋白组的差异分析筛选TP53mut-KRASamp调控的转录因子,并确定候选转录因子与CCL21的结合位点。我们构建了CCL21启动子区的质粒,通过荧光素酶报告系统明确结合位点。随后,我们过表达或者敲低转录因子来检测CCL21的表达水平;其次,我们在表达和不表达TP53mut-KRASamp的细胞中,敲低转录因子来检测CCL21的表达水平,证明TP53mut-KRASamp是通过转录因子来调控CCL21的表达的。我们同时利用鼠源TNBC细胞系构建原位成瘤模型,在不表达TP53mut-KRASamp的体内模型中通过下游分子的回复实验在体内验证TP53mut-KRASamp/转录因子/CCL21轴对肿瘤生长和关键微环境细胞类型丰度的影响。
(4)探索TP53mut-KRASamp/转录因子/CCL21/CCR7+树突状细胞轴在TNBC中的临床转化价值
1)利用临床队列验证TP53mut-KRASamp作为TNBC免疫治疗疗效预测标志物的效能:本中心临床治疗队列丰富,包括真实世界免疫治疗队列、TNBC新辅助免疫治疗临床试验(NCT04613674)及晚期免疫治疗临床试验(NCT03805399、NCT04129996及NCT 04395989)等,且各患者均有完善的疗效信息记录及匹配基因组靶向测序数据。我们通过鉴定TNBC免疫治疗队列中TP53及KRAS的状态,在多因素Cox比例风险模型中纳入TP53mut-KRASamp与免疫治疗的交互项,分析TP53mut-KRASamp与免疫治疗疗效的相关性。
2)构建TNBC免疫治疗疗效预测模型:我们将结合患者临床治疗信息、病理及免疫组化指标、TP53mut-KRASamp状态及其他基因组数据,使用随机森林模型构建TNBC患者免疫治疗疗效预测模型。建模时采用3折交叉验证策略,以ROC曲线下面积(AUC)及F1 score评估疗效预测效能,并在外部队列中验证。
2.6 技术路线
2.7 可行性分析
(1)前期研究基础扎实
申请人围绕“聚焦乳腺癌基因组与临床特征、优化个体化精准诊疗策略”为主线开展了系列研究。其中,针对基因组学指导下乳腺癌精准治疗策略的方向,申请人已有扎实的前期研究基础,并发表多篇基础与转化研究,现简述如下:1)前期申请人已完成大规模乳腺癌基因组靶向测序队列构建,相关成果发表于Cell Discovery 2023(PMID:38114467;申请人为共一第二);2)申请人基于所构建的大规模基因组队列开展的转化研究,揭示了乳腺癌基因组变异互作在乳腺癌精准治疗疗效预测中的价值,相关研究有望优化乳腺癌精准治疗策略(Cancer Cell 2024;PMID:38593782;申请人为第一作者);3)申请人参与了所在团队前期开展的探索Luminal乳腺癌多组学特征的研究,并解析了基因组变异互作在调控细胞周期、影响Luminal乳腺癌增殖和治疗敏感性等方面的作用,相关成果发表于Nature Genetics 2023(PMID:37770634;申请人为共一第五);4)申请人同时具备扎实的乳腺癌临床基础,在乳腺癌的临床实践中总结常见临床问题并开展研究,阐明乳腺癌临床病理特征及分子生物学特征与患者个体化诊断和治疗结局的相关性,以第一作者发表成果于NPJ Breast Cancer 2023(PMID:37061514)、Journal of the National Comprehensive Cancer Network: JNCCN 2019(PMID:31805535)和Cancer Research and Treatment 2020(PMID:31801318)。综合所述,申请人前期的研究成果将为后续本项目的推进提供扎实基础。
(2)理论可行
本研究前期结果表明,TP53mut-KRASamp占TNBC患者的10.4%,占比人群较高,并提示患者的较差预后。初步的实验探索表明, TP53mut-KRASamp与TNBC微环境表型和免疫治疗疗效具有相关性。根据既往研究表明,部分基因变异互作事件可提示肿瘤免疫微环境组分,并作为实体瘤免疫治疗疗效的预测标志物。因此,本项目立足于扎实的预实验结果和充分的文献调研提出研究假说,理论依据充分,具有较高的理论可行性。
(3)技术可行,平台支撑
申请人依托于复旦大学附属肿瘤医院乳腺外科/复旦大学乳腺癌研究所。复旦大学附属肿瘤医院乳腺外科拥有强劲临床实力,2023年收治乳腺癌患者逾 10000 例,拥有超过3万病例的乳腺癌数据库,临床队列丰富,包括真实世界治疗队列以及各类临床试验队列,为本项目的临床转化提供基础。此外,科室也已建立规范化的标本收集和保存流程,可以满足本项目研究所需的组织样本。复旦大学乳腺癌研究所系“上海市重点实验室”,各类常规实验仪器设备齐全。研究所已搭建完善的乳腺癌细胞系、患者来源类器官和肿瘤组织碎片及OVA-OTI系统等实验平台,且各实验模型均匹配有复旦大学附属肿瘤医院精准医学中心的基因组靶向测序数据,满足本项目的开展需要。复旦大学肿瘤医院动物实验中心也为后续动物实验的开展提供了支持。
(4)人才支持
申请人从事乳腺癌临床与转化研究6年,以第一作者和共同第一作者在JNCCN、Cell Discovery、Nature Genetics、NPJ Breast Cancer、Breast Cancer Research and Treatment和Cancer Research and Treatment等杂志发表SCI论著6篇。此外,申请人关于基因组变异互作与乳腺癌精准治疗策略优化的研究已发表于Cancer Cell(第一作者),该研究亦与本项目直接相关。申请人擅长生物信息学分析,在临床数据分析和分子生物学实验等方面技术熟练,积累了丰富的研究经验,能保证项目的顺利开展和完成。
申请人所在课题组长期聚焦“乳腺癌分子生物学特征和精准治疗策略优化”,近5年来在Cancer Cell、Nature Cancer、Cell Metabolism、Cell Research、Science Translational Medicine、The Lancet Oncology、Journal of Clinical Oncology和JAMA Oncology等杂质发表多篇研究。此外,复旦大学附属肿瘤医院乳腺外科邵志敏教授和江一舟研究员将为本项目的后续工作提供理论指导和技术支持。
执行年限和计划进度
时间 | 节点目标 |
|---|---|
时间 2024 | 节点目标 第四季度:
1. 目标:
(1)完成多组学数据的收集和初步分析。
(2)确定TP53mut-KRASamp对TNBC微环境表型的影响。
2. 关键节点:
(1)队列整理: 整理乳腺癌多组学数据库和靶向测序数据库。
(2)初步分析: 对基因组学数据进行生物信息学分析,鉴定TNBC中显著的基因组变异互作事件。 |
时间 2025 | 节点目标 第一季度:
1. 目标:
(1)在多个外部队列中验证TP53mut-KRASamp与免疫微环境激活相关的基因组变异互作事件。
2. 关键节点:
(1)外部队列验证: 在TCGA、METABRIC和PCAWG等多个外部队列中验证TP53mut-KRASamp的发现。 |
时间 2025 | 节点目标 第二季度:
1. 目标:
(1)利用体外实验验证TP53mut-KRASamp对TNBC免疫治疗疗效的影响。
2. 关键节点:
(1)体外实验设计: 筛选不同基因型的PDO,进行共培养和抗PD-1单抗处理。
(2)流式细胞术分析: 使用抗PD-1单抗处理不同基因型的PDTF,分析CD3+CD8+ T细胞丰度及免疫激活相关指标的改变。 |
时间 2025 | 节点目标 第三季度:
1. 目标:
(1)完成体外实验,验证TP53mut-KRASamp对TNBC免疫治疗疗效的影响。
(2)构建小鼠原位成瘤模型。
2. 关键节点:
(1)体外实验执行: 完成PDO和CD8+T细胞的共培养,检测肿瘤活性。
(2)小鼠模型构建: 利用TP53缺失且相对低表达KRAS的小鼠TNBC细胞系4T1构建具有不同基因特征的细胞模型。 |
时间 2025 | 节点目标 第四季度:
1.目标:
(1)验证TP53mut-KRASamp对TNBC免疫治疗疗效的影响。
(2)实验解析TP53mut-KRASamp调控的肿瘤微环境表型及具体机制。
2关键节点:
(1)体内实验执行: 对每只小鼠进行抗PD-1单抗和IgG给药,分析肿瘤生长曲线及瘤体重量。
(2)机制探索: 通过流式细胞术检测、免疫组化染色和单细胞转录组测序,解读不同基因型肿瘤微环境中关键细胞类型的变化。 |
时间 2026 | 节点目标 第一季度:
1. 目标:
(1)完成体内外实验,解析TP53mut-KRASamp调控的肿瘤微环境表型及具体机制。
2. 关键节点:
(1)机制探索深入: 完成流式细胞术检测、免疫组化染色和单细胞转录组测序,鉴定TP53mut-KRASamp影响的关键免疫微环境细胞类型。
(2)体外共培养: 通过CCR7+树突状细胞与CD8+T细胞的体外共培养进一步确认其对CD8+T细胞的杀伤功能影响。 |
时间 2026 | 节点目标 第二季度:
1. 目标:
(1)完成TP53mut-KRASamp影响关键微环境细胞类型的具体机制研究。
2. 关键节点:
(1)RNA-seq测序: 验证影响的关键信号通路变化。
(2)qPCR及Western blot: 验证包括CCL21在内的细胞因子在mRNA和蛋白水平的表达量变化。 |
时间 2026 | 节点目标 第三季度:
1. 目标:
(1)鉴定TP53mut-KRASamp调控细胞因子表达的具体机制。
2. 关键节点:
(1)转录因子筛选: 筛选TP53mut-KRASamp调控的转录因子。
(2)Luciferase和CHIP-qPCR实验验证转录因子与CCL21的结合位点。 |
时间 2026 | 节点目标 第四季度:
1. 目标:
(1)验证TP53mut-KRASamp/转录因子/CCL21/CCR7+树突状细胞轴在TNBC中的临床转化价值。
2. 关键节点:
(1)临床样本分析: 分析TP53及KRAS的状态,验证与免疫治疗疗效的相关性。
(2)疗效预测模型构建: 结合临床治疗信息和基因组数据,构建预测模型。 |
时间 2027 | 节点目标 第一季度:
1. 目标:
(1)完成临床样本的深入分析,验证TP53mut-KRASamp的疗效预测标志物效能。
2. 关键节点:
(1)临床样本深入分析: 完成临床样本的深入分析,验证TP53mut-KRASamp与免疫治疗疗效的相关性。 |
时间 2027 | 节点目标 第二季度:
1. 目标:
(1)完成研究成果的总结和准备发表。
2. 关键节点:
(1)成果总结: 准备研究论文和报告。
(2)论文撰写: 完成研究论文的撰写。 |
时间 2027 | 节点目标 第三季度:
1. 目标:
(1)完成研究成果的发表。
(2)专利申请。
2. 关键节点:
(1)论文提交: 投稿研究成果至相关学术期刊。
(2)申请专利。 |
成果形式和考核指标
(1)明确TP53mut-KRASamp调控TNBC免疫微环境的具体机制;
(2)基于体外实验、体内动物模型和临床队列分析,明确TP53mut-KRASamp作为TNBC免疫治疗疗效预测标志物的可行性;
(3)在国内外主流期刊上发表具有临床转化价值的高质量论著1-2篇;
(4)申请发明专利1-2项;
(5)培养已获得博士学位的青年科技人才1名,协助培养博士研究生1名。
主要研究人员情况
项目负责人:林偲进
复旦大学附属肿瘤医院,医师
教育经历:
(1)2020-09至2023-06:复旦大学,肿瘤学,博士
(2)2017-09至2020-06:上海交通大学,外科学,硕士
(3)2012-09至2017-06:中山大学,临床医学,学士
工作经历:
2023-07至今:复旦大学附属肿瘤医院,外科基地,医师
近五年代表性论著:
(1)Lin Cai-Jin; Jin Xi; Ma Ding; Chen Chao; Ou-Yang Yang; Pei Yu-Chen; Zhou Chao-Zheng; Qu Fei-Lin; Wang Yun-Jin; Liu Cheng-Lin; Fan Lei; Hu Xin; Shao Zhi-Ming; Jiang Yi-Zhou. Genetic interactions reveal distinct biological and therapeutic implications in breast cancer. Cancer Cell, 2024, 42(4): 701-719.(期刊论文;IF:48.8;第一作者)
(2)Caijin Lin; Jiayi Wu; Shuning Ding; Chihwan Goh; Lisa Andriani; Shuangshuang Lu; Kunwei Shen; Li Zhu. Subdivision of M1 Stage for De Novo Metastatic Breast Cancer to Better Predict Prognosis and Response to Primary Tumor Surgery, Journal of the National Comprehensive Cancer Network, 2019, 17(12): 1521-1528.(期刊论文;IF:14.8;第一作者)
(2)林彩锦;吴佳怡;丁淑宁;高志焕;丽莎-安德里亚尼;卢双双;沈坤伟;朱莉新发转移性乳腺癌M1分期的细分能更好地预测预后和对原发肿瘤手术的反应,《美国国家综合癌症网络杂志》,2019,17(12):1521-1528.(期刊论文;IF:14.8;第一作者)
(3)Cai-Jin Lin; Wen-Xuan Xiao; Tong Fu; Xi Jin; Zhi-Ming Shao; Gen-Hong Di ; Calcifications in triple-negative breast cancer: Molecular features and treatment strategies, npj Breast Cancer 2023, 9(1): 26.(期刊论文;IF:6.5;第一作者)
(4)Chao Chen; Cai-Jin Lin; Yu-Chen Pei; Ding Ma; Li Liao; Si-Yuan Li; Lei Fan; Gen-Hong Di; Song-Yang Wu; Xi-Yu Liu; Yun-Jin Wang; Qi Hong; Guo-Liang Zhang; Lin-Lin Xu; Bei-Bei Li; Wei Huang; Jin-Xiu Shi; Yi-Zhou Jiang; Xin Hu; Zhi-Ming Shao. Comprehensive genomic profiling of breast cancers characterizes germline-somatic mutation interactions mediating therapeutic vulnerabilities, Cell Discovery, 2023, 9(1): 125.(期刊论文;IF:13.0;共同第一作者排第二)
(5)Xi Jin; Yi-Fan Zhou; Ding Ma; Shen Zhao; Cai-Jin Lin; Yi Xiao; Tong Fu; Cheng-Lin Liu; Yi-Yu Chen; Wen-Xuan Xiao; Ya-Qing Liu; Qing-Wang Chen; Ying Yu; Le-Ming Shi; Jin-Xiu Shi; Wei Huang; John F. R. Robertson; Yi-Zhou Jiang; Zhi-Ming Shao. Molecular classification of hormone receptor-positive HER2-negative breast cancer, Nature Genetics, 2023, 55(10): 1696-1708.(期刊论文;IF:31.7;共同第一作者排第五)
(6)Qu Fei-Lin; Lin Cai-Jin; Liu Zhen-Bin; Cao A-Yong; Wu Jiong; Liu Guang-Yu; Yu Ke-Da; Di Gen-Hong; Li Jun-Jie; Shao Zhi-Ming. Omission of axillary surgery for ipsilateral breast tumor recurrence with negative nodes after previous breast-conserving surgery: is it oncologically safe? Breast Cancer Research and Treatment, 2022, 196(1): 97-109. (期刊论文;IF:3.0;共同第一作者排第二)
(7)Caijin Lin; Jiayi Wu; Shuning Ding; Chihwan Goh; Lisa Andriani; Kunwei Shen; Li Zhu. Impact of Prior Cancer History on the Clinical Outcomes in Advanced Breast Cancer: A Propensity Score–Adjusted, Population-Based Study, Cancer Research and Treatment, 2020, 52(2): 552- 562.(期刊论文;IF:4.1;第一作者)
(7)林才金;吴佳怡;丁姝宁;吴志焕;丽莎-安德里亚尼;沈坤伟;朱莉既往癌症史对晚期乳腺癌临床结局的影响:基于人群的倾向得分调整研究》,《癌症研究与治疗》,2020年,52(2):552- 562.(期刊论文;if:4.1;第一作者)
其他代表性研究成果和学术奖励
(1)软件著作权:邵志敏; 江一舟; 林偲进; 乳腺癌人群及健康对照全外显子芯片测序数据库软件, 2023SR0955460, 原始取得, 全部权利, 2021-12-17
(2) 会议报告:Caijin Lin; Jiayi Wu; Shuning Ding; Lisa Andriani; Weilin Chen; Deyue Liu; Li Zhu. Abstract P2-11-15: A novel scoring system based on the clinical and genomic variables to predict the early relapse in estrogen receptor-positive/HER2-negative (ER+/HER2-) breast cancer, San Antonio Breast Cancer Symposium, San Antonio, TX.(2019-12-10至2019-12-14)
(2)会议报告:林彩金 吴佳怡 丁姝宁 Lisa Andriani 陈伟林 刘德跃 朱莉.摘要P2-11-15:基于临床和基因组变量预测雌激素受体阳性/HER2-阴性(ER+/HER2-)乳腺癌早期复发的新型评分系统,圣安东尼奥乳腺癌研讨会,德克萨斯州圣安东尼奥(2019-12-10至2019-12-14)
(3)会议报告:Caijin Lin; Jiayi Wu; Li Zhu. Establishment and validation of M1 stage subdivisions for patients with de novo metastatic breast cancer: A population-based study, ESMO 2018 Congress, Munich(2018-10-19至2018-10-23)
(3)会议报告:林才锦; 吴佳怡; 朱莉.新发转移性乳腺癌患者M1分期的建立与验证:基于人群的研究,ESMO 2018大会,慕尼黑(2018-10-19至2018-10-23)
(4)专利:瞿飞麟; 林偲进; 李俊杰; 带有评估同侧乳房肿瘤复发时腋窝淋巴结转移风险界面的手机, 2022-10, 中国, ZL202230669310.8
主要成员1:瞿飞麟
复旦大学附属肿瘤医院,主治医师
教育经历:
(1)2014-08至2017-07:上海交通大学,外科学,博士
(2)2009-09至2014-07:上海交通大学,临床医学,学士
工作经历:
2020-08至今:复旦大学附属肿瘤医院,乳腺外科,主治医师
2019-08至2020-07:复旦大学附属肿瘤医院,乳腺外科,医师
代表性论著:
(1)Qu Fei-Lin, Lin Cai-Jin, Liu Zhe-Bbin, Cao A-Yong, Wu Jiong, Liu Guang-Yu, Yu Ke-Da, Di Gen-Hong, Li Jun-Jie, Shao Zhi-Ming. Omission of axillary surgery for ipsilateral breast tumor recurrence with negative nodes after previous breast-conserving surgery: is it oncologically safe? Breast Cancer Res Treat. 2022 Nov;196(1):97-109.(期刊论文,第一作者;IF:3.0)
(2)Qu Fei-Lin, Mao Rui, Liu Zhe-Bin, Lin Cai-Jin, Cao A-Yong, Wu Jiong, Liu Guang-Yu, Yu Ke-Da, Di Gen-Hong, Li Jun-Jie, Shao Zhi-Ming. Spatiotemporal Patterns of Loco-Regional Recurrence After Breast-Conserving Surgery. Front Oncol. 2021 Aug 30;11:690658. (期刊论文,第一作者;IF:3.5)
(3)Qu Fei-Lin, Chen Xiao-Song, Fei Xiao-Chun, Lin Lin, Gao Wei-Qi, Zong Yu, Wu Jia-Yi, Huang Ou, He Jian-Rong, Zhu Li, Chen Wei-Guo, Li Ya-Fen, Shen Kun-Wei. A nomogram to predict adjuvant chemotherapy recommendation in breast cancer patients with intermediate recurrence score. Chin J Cancer Res. 2018 Apr;30(2):222-230. (期刊论文,第一作者;IF:7.0)
(4)Lin Cai-Jin; Jin Xi; Ma Ding; Chen Chao; Ou-Yang Yang; Pei Yu-Chen; Zhou Chao-Zheng; Qu Fei-Lin; Wang Yun-Jin; Liu Cheng-Lin; Fan Lei; Hu Xin; Shao Zhi-Ming; Jiang Yi-Zhou. Genetic interactions reveal distinct biological and therapeutic implications in breast cancer. Cancer Cell, 2024, 42(4): 701-719.(期刊论文;IF:48.8;参与作者)
其他代表性研究成果和学术奖励
(1)会议报告:Feilin Qu; Xiaosong Chen; Lin Lin; Kunwei Shen ; Nomogram to Predict Adjuvant Chemotherapy Recommendation in Patients With Breast Cancer With Intermediate Recurrence Score, 2018 NCCN Annual Conference, Orlando, Florida, 2018-3-22至2018-3-233
(2)人才培养:2016年法国普外科专科医师培训 (DIPLOME DE FORMATION MÉDICALE SPÉCIALISÉE EN CHIRURGIE GENERAL Version VISCERALE), 在读博士, 2015-11-1至2016-10-30
主要成员2:周朝政
复旦大学附属肿瘤医院,博士研究生
教育经历:
(1)2023-09至今:复旦大学,肿瘤学,博士
(2)2018-09至2023-06:南方医科大学,临床医学,学士
工作经历:
无
代表性论著:
(1)Zhou Chao-Zheng, Peng Sheng-Kun, Lin An-Qi, Jiang Ai-Min, Peng Yuan-Xi, Gu Tian-Qi, Liu Zao-Qu, Cheng Quan, Zhang Jian, Luo Peng. Psychiatric disorders associated with immune checkpoint inhibitors: a pharmacovigilance analysis of the FDA Adverse Event Reporting System (FAERS) database. EClinicalMedicine. 2023 Apr 21;59:101967. (期刊论文,第一作者;IF:9.6)
(2)Zhou Chao-Zheng, Lin An-Qi, Cao Man-Ming, Ding Wei-Min, Mou Wei-Ming, Guo Ning-Yi, Chen Zhen-Yu, Zhang Jian, Luo Peng. Activation of the DDR Pathway Leads to the Down-Regulation of the TGFβ Pathway and a Better Response to ICIs in Patients With Metastatic Urothelial Carcinoma. Front Immunol. 2021 Jun 18;12:634741. (期刊论文,第一作者;IF:5.7)
(3)Lin Cai-Jin; Jin Xi; Ma Ding; Chen Chao; Ou-Yang Yang; Pei Yu-Chen; Zhou Chao-Zheng; Qu Fei-Lin; Wang Yun-Jin; Liu Cheng-Lin; Fan Lei; Hu Xin; Shao Zhi-Ming; Jiang Yi-Zhou. Genetic interactions reveal distinct biological and therapeutic implications in breast cancer. Cancer Cell, 2024, 42(4): 701-719.(期刊论文;IF:48.8;参与作者)
主要成员3:沈褚涵
复旦大学附属肿瘤医院,硕士研究生
教育经历:
(1)2022-09至今:复旦大学,肿瘤学,硕士
(2)2017-09至2022-06:厦门大学,临床医学,学士
工作经历:
无
代表性论著:
(1)Huang Ping, Sun Qian, Zhuang Wen-Xin, Peng Kuan, Wang Dai, Yao You-Liang, Guo Dong-Bei, Zhang Lu, Shen Chu-Han, Sun Meng-Yun, Tang Chao-Ying, Teng Bo-Gang, Zhang Yong-Xing. Epac1, PDE4, and PKC protein expression and their association with AKAP95, Cx43, and cyclinD2/E1 in breast cancer tissues. Thorac Cancer. 2017 Sep;8(5):495-500.(期刊论文;IF:2.3;参与作者)
项目研究人员表
序号 | 姓名 | 性别 | 承担角色 | 现工作单位 | |
|---|---|---|---|---|---|
1 | 林偲进 | 男 | 项目负责人 | 复旦大学附属肿瘤医院 | |
2 | 瞿飞麟 | 男 | 项目参与人员 | 复旦大学附属肿瘤医院 | |
3 | 周朝政 | 男 | 项目参与人员 | 复旦大学附属肿瘤医院 | |
4 | 沈褚涵 | 男 | 项目参与人员 | 复旦大学附属肿瘤医院 |
涉及人类遗传资源情况表
序号 | 涉及人类遗传资源活动类型 | 涉及活动相关内容 | 审批书号/备案号 | 项目名称 |
|---|
暂无数据